Вирус папилломы человека: чем опасен и как его вовремя выявить
Организованный скрининг – лучшая мера профилактики рака шейки матки. Потому что эффективного лекарства от вируса папилломы человека, который вызывает заболевание, пока нет.
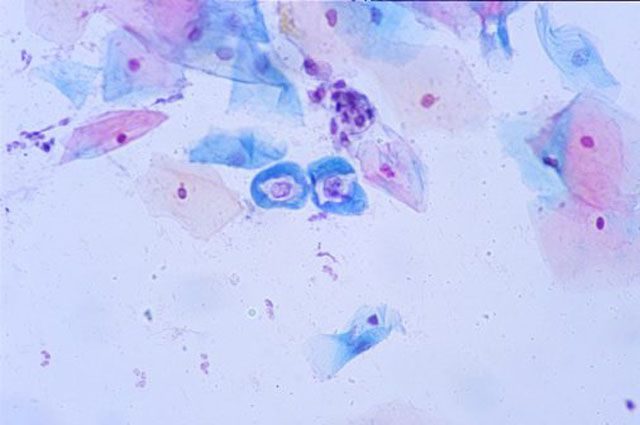
О вирусе папилломы человека (ВПЧ) его носители узнают, как правило, когда он зримо дает о себе знать: на слизистой половых органов возникают остроконечные кондиломы (как у женщин, так и мужчин) или на визите у гинеколога выявляются патологические изменения на шейке матки. Можно ли избавиться от вируса раз и навсегда? Как избежать онкологических заболеваний, которые этот вирус провоцирует?
Вездесущий и многообразный
Вирус папилломы человека (ВПЧ) известен медикам давно – именно он вызывает образование бородавок. Однако пристальное внимание ученых и врачей ВПЧ привлек тогда, когда была выяснена его прямая связь с раком шейки матки: более чем в 90% случаев в материалах биопсий, взятых из новообразований, обнаруживается этот вирус.
При этом носителями ВПЧ являются почти 70% населения (среди женщин этот процент выше). Передается он только от человека к человеку. Основной путь передачи – половой. В последнее время кондиломы все чаще обнаруживаются на коже анальной области и на слизистой прямой кишки, что связано с ростом популярности анального секса. Вирусные частицы настолько малы, что при половом контакте презервативы не защищают от их передачи на 100%, но несколько снижают риск передачи. И младенцы не застрахованы от заражения ВПЧ: оно происходит при родах и проявляется множественными папилломами в области гортани. Возможно заражение бытовым путем, например, через прикосновения.
На сегодняшний день известно более 100 видов ВПЧ. Из них более 40 могут вызвать различные поражения аногенитального тракта (половые органы и область ануса) мужчин и женщин. ВПЧ условно разделяют на три основные группы: неонкогенные (ВПЧ 1-го, 2-го, 3-го, 5-го типов), низкого онкогенного риска (в основном ВПЧ 6, 11, 42, 43, 44), высокого онкогенного риска (ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68). Высокоонкогенные типы ВПЧ 16 и 18 встречаются в 70% случаев, тип 16 приводит в 41–54% случаев к раку. В последнее время ученые обнаруживают онкогенные свойства у штаммов, ранее считавшихся безопасными.
Попав в организм, вирус проникает в нижний слой эпителия, причем наиболее уязвимой является зона перехода многослойного плоского эпителия шейки матки в цилиндрический. В зараженной клетке вирус существует в двух формах: доброкачественной, когда он живет вне хромосомы хозяина, и злокачественной, когда ДНК вируса встраивается в геном и вызывает перерождение тканей. Инкубационный период длится от нескольких недель до нескольких лет.
Почти в 90% случаев организм избавляется от вируса самостоятельно в течение 6–12 месяцев. Но под действием различных факторов (ослабление иммунитета, инфекционные и соматические заболевания) может произойти активация вируса, и болезнь переходит в стадию клинических проявлений.
Лечить нельзя наблюдать
Клинические проявления ВПЧ могут быть в виде остроконечных кондилом (их еще называют аногенитальными бородавками), которые бывают как единичными, так и множественными, расположенными на слизистой преддверия влагалища, половых губ и головки полового члена, – не заметить трудно. А вот онкологические заболевания (главным образом рак шейки матки, вульвы, влагалища и полового члена) часто выявляют с большим опозданием.
В подавляющем большинстве случаев рак шейки матки (РШМ) провоцирует ВПЧ 16‑го и 18‑го серотипов. Исследования ВОЗ показали, что риск многократно возрастает при активной половой жизни с частой сменой половых партнеров. Прямая зависимость между ВПЧ и онкологическими заболеваниями побудило многие развитые страны к проведению скрининга (систематических массовых исследований с целью раннего выявления инфицирования ВПЧ). По словам профессора Научного центра акушерства, гинекологии и перинатологии им. академика В. И. Кулакова Инны Аполихиной, большинство женщин с запущенными стадиями РШМ более 10 лет не посещали гинеколога.
«Для того чтобы найти их и достучаться до них, нужна государственная скрининговая программа с формированием единой цитологической базы данных, – уверена профессор Аполихина. – С точки зрения страховой медицины скрининг экономически выгоден. Ведь лечение инвазивного РШМ обходится в среднем в 1 млн рублей, а диагностика и лечение предракового процесса на шейке матки – примерно в 15–20 тыс. рублей».
Во время скрининга обязательно проводится цитологическое исследование шеечных мазков (PAP – smeartest). По словам эксперта, объем скрининга может меняться в зависимости от возраста женщины (только PАР-мазок или РАР-мазок + исследование на ВПЧ).
К сожалению, специфической терапии ВПЧ не существует: устранить вирус из организма при помощи лечебных препаратов невозможно. Врачи могут пока только удалять остроконечные кондиломы, при необходимости – провести хирургическое вмешательство на шейке матки. Их объем различается в зависимости от стадии процесса. Разработаны щадящие методики, при которых женщина, на ранней стадии прооперированная по поводу РШМ, может стать матерью.
А что делать, если в ходе исследования обнаружен ВПЧ в организме, но клинических проявлений нет? Специалистами Научного центра акушерства, гинекологии и перинатологии им. академика В. И. Кулакова разработана тактика ведения пациентов в зависимости от результатов исследования. Если ПЦР (полимеразно-цепная реакция) выявила присутствие ВПЧ низкого онкогенного риска, то в любом случае необходимо провести повторное исследование через год. При наличии остроконечных кондилом – удалить их. Используется крио-, электро- и лазерная коагуляция, радиоволновой нож, а также химическая коагуляция. Несмотря на то, что существует ряд препаратов, позволяющих удалять бородавки самостоятельно, делать это при их локализации в аногенитальной области ни в коем случае не стоит: при непрофессиональных манипуляциях побочным эффектом может быть распространение вируса на прилегающие ткани, поврежденные в процессе удаления пораженных.
Показано также лечение иммуномодуляторами и Индинолом Форто (селективный модулятор эстрогеновых рецепторов). Если клинических проявлений нет, то следует принимать по 400 мг в сутки 3 месяца, если есть – то в той же дозе полгода.
Если же тесты показывают наличие вирусов высокоонкогенных типов ВПЧ, то тактика меняется. При отсутствии клинических проявлений необходимо два раза в год делать цитологическое исследование шеечных мазков, принимать иммуномодуляторы и Индинол Форто в течение полугода. При наличии клинических проявлений на шейке матки удаляются патологические участки, используется Промисан (препарат с множественной противоопухолевой активностью, эффективен на ранних стадиях процесса) и контролируется ход лечения не реже одного раза в три месяца.
По поводу использования иммуномодуляторов и противовирусных средств единого мнения в мировой врачебной практике не существует. «С позиции доказательной медицины только местное использование иммуномодуляторов является доказанным, – говорит Инна Аполихина. – Среди них можно выделить крем Имиквимод. Хотя в России накоплен большой материал по использованию системных иммуномодуляторов, чаще мы их рекомендуем при рецидивирующих процессах». Но в любом случае главным орудием врача пока является тщательное наблюдение. Если вирус был обнаружен – расслабляться нельзя.
Мужчины – в зоне риска
Известно, что наличие вируса у мужчин – партнеров женщин с ВПЧ, по данным различных исследований, в среднем составляет от 25 до 70%, то есть данные очень вариабельны. Часто ВПЧ-инфицированный мужчина является резервуаром инфекции и способствует более высокому риску передачи вируса женщине.
«Нужно разделять носительство ВПЧ без клинических проявлений и ситуации, когда вирус приводит к клиническим проявлениям в виде остроконечных кондилом, иногда многочисленных, на половом члене, – говорит Инна Аполихина. – Поэтому чаще мы рекомендуем обследовать мужчин на ВПЧ, если у женщин имеются клинические проявления, а не латентное носительство вируса». Наиболее эффективным является обследование, направленное на обнаружение ДНК ВПЧ в соскобе эпителия крайней плоти головки полового члена, в последнее время активнее рекомендуется и обследование материала, взятого из ануса. Для этого используются две методики: ПЦР и метод ДНК-гибридизации в растворе (этот тест называется Дайджин-тест). Однако в ряде европейских стран обследование мужчин не считается обязательным.
Как у женщин, так и у мужчин ВПЧ также является одним из этиологических факторов развития предрака и рака анальной области.
Полагают, что спектр типов ВПЧ, поражающих эпителий анальной области, идентичен таковому при поражениях шейки матки. В структуре заболеваемости анальный рак в 40% случаев поражает мужчин, причем частота анального рака имеет тенденцию к росту, увеличиваясь ежегодно на 2%, особенно среди населения в группе риска. К факторам риска относятся прежде всего анальная ВПЧ- инфекция, распространение которой среди лиц с наличием анальных половых контактов составляет около 50–60%. Следует отметить связь анальной ВПЧ-инфекции, анального рака и предрака с ВИЧ. Заболеваемость среди ВИЧ-положительных пациентов выше, чем у ВИЧ-отрицательных. Методом ранней диагностики этих процессов является цитологический скрининг: анальная цитология оценивается по тем же критериям, что и цервикальная. Также высоко информативна аноскопия. Исследуют и лечат мужчин дерматовенерологи. При наличии вируса и отсутствии клиники – тактика наблюдательная, подразумевает ВПЧ-тест и цитологический скрининг раз в 6 месяцев. При наличии остроконечных кондилом их необходимо удалять.
Вакцинация: «за» и «против»
Особая тема – вакцинация девочек и молодых женщин для защиты от рака шейки матки. В США разработана и применяется с 2006 г. вакцина Гардасил, которая эффективна против четырех штаммов вируса. Вакцинацию проводят девочкам начиная с 11–12 лет. Четыре страны, в том числе США и Канада, ввели и вакцинацию мальчиков с целью снизить количество носителей вируса. У вакцинации есть много как сторонников, так и противников. Множество клинических исследований доказало, что если вакцину вводят девушкам, не имевшим сексуальных контактов и неинфицированным штаммами 16 и 18 (это может быть в том случае, если у нее не было в прошлом сексуальных отношений), то после полного курса вакцинации практически исключен риск инфицирования этими штаммами. Однако на сегодня риск поражений ШМ составляет 2% в вакцинированной популяции и 2,8% в невакцинированной. Последние данные свидетельствуют, что РШМ могут вызывать и штаммы, ранее считавшиеся неонкогенными.
При вакцинации молодых женщин, уже имевших сексуальные отношения, уровень снижения риска развития поражений шейки матки весьма невелик. Известный французский ученый Клод Беро (Claude Beraud) полагает, что вакцинация может усыпить бдительность подростков и приведет к тому, что они будут пренебрегать мерами защиты от инфекций и профилактическими исследованиями. А именно регулярные профилактические осмотры у гинекологов дают гарантию раннего обнаружения и излечения патологических процессов на шейке матки.
Спасение – в скрининге
Первой, в 1949 г., начала эту работу Канада. Скрининг дал немедленные результаты: сначала снижение заболеваемости на 78%, смертности – на 72%. В 50‑е годы США и Китай смогли снизить частоту РШМ более чем в 10 раз. В 60‑е годы скрининг начали проводить Япония, Финляндия, Швеция, Исландия, через десять лет к ним присоединились Германия, Бразилия и др. страны. Следствием этих действий стало снижение РШМ в этих странах в среднем на 50–80%.
В СССР приказ Минздрава о создании соответствующих лабораторий был издан в 1976 г. В настоящее время организованного скрининга РШМ в России нет. В 2002 году Департамент здравоохранения г. Москвы утвердил программу «Целевая диспансеризация женского населения по выявлению заболеваний шейки матки».
Цитологический скрининг проводился женщинам 35–69 лет один раз в три года. К 2010 г. общий процент случаев РШМ составил 22–24%, причем частота РШМ I–II стадии повысилась за годы исследования с 57 до 67%. Гинекологи настаивают на необходимости разработки национальной программы с определением кратности, объема и особенностей скрининга в различных возрастных группах женщин.
Научный центр акушерства, гинекологии и перинатологии им. академика В. И. Кулакова как главный методический центр страны планирует реализовать пилотный проект по скринингу рака шейки матки в Липецкой области. Цитологический метод – единственный для скрининга в больших популяциях.
Но его чувствительность неабсолютна: 66–83%. В 70–90% ложноотрицательные цитологические ответы случаются из-за низкого качества взятых мазков, в 10–30% налицо ошибочная интерпретация цитологических данных.
Именно уникальные возможности цитологического скрининга РШМ сохраняют здоровье и жизнь женщин. «С учетом его относительно низкой стоимости необходимо обеспечить именно организованный скрининг женщин. Следует рассмотреть вопрос о включении скрининга в систему обязательного медицинского страхования», – уверена профессор Аполихина.
Доказано, что финансовые затраты на проведение эффективного скрининга существенно ниже, чем на лечение больных с инвазивным раком шейки матки. Систему скрининга могут эффективно дополнить меры индивидуальной профилактики с использованием более частого обследования в группах повышенного риска с привлечением более дорогих, но гораздо более чувствительных молекулярно-биологических методов определения ДНК ВПЧ.

О вирусе папилломы человека (ВПЧ) его носители узнают, как правило, когда он зримо дает о себе знать: на слизистой половых органов возникают остроконечные кондиломы (как у женщин, так и мужчин) или на визите у гинеколога выявляются патологические изменения на шейке матки. Можно ли избавиться от вируса раз и навсегда? Как избежать онкологических заболеваний, которые этот вирус провоцирует?
Вездесущий и многообразный
Вирус папилломы человека (ВПЧ) известен медикам давно – именно он вызывает образование бородавок. Однако пристальное внимание ученых и врачей ВПЧ привлек тогда, когда была выяснена его прямая связь с раком шейки матки: более чем в 90% случаев в материалах биопсий, взятых из новообразований, обнаруживается этот вирус.
При этом носителями ВПЧ являются почти 70% населения (среди женщин этот процент выше). Передается он только от человека к человеку. Основной путь передачи – половой. В последнее время кондиломы все чаще обнаруживаются на коже анальной области и на слизистой прямой кишки, что связано с ростом популярности анального секса. Вирусные частицы настолько малы, что при половом контакте презервативы не защищают от их передачи на 100%, но несколько снижают риск передачи. И младенцы не застрахованы от заражения ВПЧ: оно происходит при родах и проявляется множественными папилломами в области гортани. Возможно заражение бытовым путем, например, через прикосновения.
На сегодняшний день известно более 100 видов ВПЧ. Из них более 40 могут вызвать различные поражения аногенитального тракта (половые органы и область ануса) мужчин и женщин. ВПЧ условно разделяют на три основные группы: неонкогенные (ВПЧ 1-го, 2-го, 3-го, 5-го типов), низкого онкогенного риска (в основном ВПЧ 6, 11, 42, 43, 44), высокого онкогенного риска (ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68). Высокоонкогенные типы ВПЧ 16 и 18 встречаются в 70% случаев, тип 16 приводит в 41–54% случаев к раку. В последнее время ученые обнаруживают онкогенные свойства у штаммов, ранее считавшихся безопасными.
Попав в организм, вирус проникает в нижний слой эпителия, причем наиболее уязвимой является зона перехода многослойного плоского эпителия шейки матки в цилиндрический. В зараженной клетке вирус существует в двух формах: доброкачественной, когда он живет вне хромосомы хозяина, и злокачественной, когда ДНК вируса встраивается в геном и вызывает перерождение тканей. Инкубационный период длится от нескольких недель до нескольких лет.
Почти в 90% случаев организм избавляется от вируса самостоятельно в течение 6–12 месяцев. Но под действием различных факторов (ослабление иммунитета, инфекционные и соматические заболевания) может произойти активация вируса, и болезнь переходит в стадию клинических проявлений.
Лечить нельзя наблюдать
Клинические проявления ВПЧ могут быть в виде остроконечных кондилом (их еще называют аногенитальными бородавками), которые бывают как единичными, так и множественными, расположенными на слизистой преддверия влагалища, половых губ и головки полового члена, – не заметить трудно. А вот онкологические заболевания (главным образом рак шейки матки, вульвы, влагалища и полового члена) часто выявляют с большим опозданием.
В подавляющем большинстве случаев рак шейки матки (РШМ) провоцирует ВПЧ 16‑го и 18‑го серотипов. Исследования ВОЗ показали, что риск многократно возрастает при активной половой жизни с частой сменой половых партнеров. Прямая зависимость между ВПЧ и онкологическими заболеваниями побудило многие развитые страны к проведению скрининга (систематических массовых исследований с целью раннего выявления инфицирования ВПЧ). По словам профессора Научного центра акушерства, гинекологии и перинатологии им. академика В. И. Кулакова Инны Аполихиной, большинство женщин с запущенными стадиями РШМ более 10 лет не посещали гинеколога.
«Для того чтобы найти их и достучаться до них, нужна государственная скрининговая программа с формированием единой цитологической базы данных, – уверена профессор Аполихина. – С точки зрения страховой медицины скрининг экономически выгоден. Ведь лечение инвазивного РШМ обходится в среднем в 1 млн рублей, а диагностика и лечение предракового процесса на шейке матки – примерно в 15–20 тыс. рублей».
Во время скрининга обязательно проводится цитологическое исследование шеечных мазков (PAP – smeartest). По словам эксперта, объем скрининга может меняться в зависимости от возраста женщины (только PАР-мазок или РАР-мазок + исследование на ВПЧ).
К сожалению, специфической терапии ВПЧ не существует: устранить вирус из организма при помощи лечебных препаратов невозможно. Врачи могут пока только удалять остроконечные кондиломы, при необходимости – провести хирургическое вмешательство на шейке матки. Их объем различается в зависимости от стадии процесса. Разработаны щадящие методики, при которых женщина, на ранней стадии прооперированная по поводу РШМ, может стать матерью.
А что делать, если в ходе исследования обнаружен ВПЧ в организме, но клинических проявлений нет? Специалистами Научного центра акушерства, гинекологии и перинатологии им. академика В. И. Кулакова разработана тактика ведения пациентов в зависимости от результатов исследования. Если ПЦР (полимеразно-цепная реакция) выявила присутствие ВПЧ низкого онкогенного риска, то в любом случае необходимо провести повторное исследование через год. При наличии остроконечных кондилом – удалить их. Используется крио-, электро- и лазерная коагуляция, радиоволновой нож, а также химическая коагуляция. Несмотря на то, что существует ряд препаратов, позволяющих удалять бородавки самостоятельно, делать это при их локализации в аногенитальной области ни в коем случае не стоит: при непрофессиональных манипуляциях побочным эффектом может быть распространение вируса на прилегающие ткани, поврежденные в процессе удаления пораженных.
Показано также лечение иммуномодуляторами и Индинолом Форто (селективный модулятор эстрогеновых рецепторов). Если клинических проявлений нет, то следует принимать по 400 мг в сутки 3 месяца, если есть – то в той же дозе полгода.
Если же тесты показывают наличие вирусов высокоонкогенных типов ВПЧ, то тактика меняется. При отсутствии клинических проявлений необходимо два раза в год делать цитологическое исследование шеечных мазков, принимать иммуномодуляторы и Индинол Форто в течение полугода. При наличии клинических проявлений на шейке матки удаляются патологические участки, используется Промисан (препарат с множественной противоопухолевой активностью, эффективен на ранних стадиях процесса) и контролируется ход лечения не реже одного раза в три месяца.
По поводу использования иммуномодуляторов и противовирусных средств единого мнения в мировой врачебной практике не существует. «С позиции доказательной медицины только местное использование иммуномодуляторов является доказанным, – говорит Инна Аполихина. – Среди них можно выделить крем Имиквимод. Хотя в России накоплен большой материал по использованию системных иммуномодуляторов, чаще мы их рекомендуем при рецидивирующих процессах». Но в любом случае главным орудием врача пока является тщательное наблюдение. Если вирус был обнаружен – расслабляться нельзя.
Мужчины – в зоне риска
Известно, что наличие вируса у мужчин – партнеров женщин с ВПЧ, по данным различных исследований, в среднем составляет от 25 до 70%, то есть данные очень вариабельны. Часто ВПЧ-инфицированный мужчина является резервуаром инфекции и способствует более высокому риску передачи вируса женщине.
«Нужно разделять носительство ВПЧ без клинических проявлений и ситуации, когда вирус приводит к клиническим проявлениям в виде остроконечных кондилом, иногда многочисленных, на половом члене, – говорит Инна Аполихина. – Поэтому чаще мы рекомендуем обследовать мужчин на ВПЧ, если у женщин имеются клинические проявления, а не латентное носительство вируса». Наиболее эффективным является обследование, направленное на обнаружение ДНК ВПЧ в соскобе эпителия крайней плоти головки полового члена, в последнее время активнее рекомендуется и обследование материала, взятого из ануса. Для этого используются две методики: ПЦР и метод ДНК-гибридизации в растворе (этот тест называется Дайджин-тест). Однако в ряде европейских стран обследование мужчин не считается обязательным.
Как у женщин, так и у мужчин ВПЧ также является одним из этиологических факторов развития предрака и рака анальной области.
Полагают, что спектр типов ВПЧ, поражающих эпителий анальной области, идентичен таковому при поражениях шейки матки. В структуре заболеваемости анальный рак в 40% случаев поражает мужчин, причем частота анального рака имеет тенденцию к росту, увеличиваясь ежегодно на 2%, особенно среди населения в группе риска. К факторам риска относятся прежде всего анальная ВПЧ- инфекция, распространение которой среди лиц с наличием анальных половых контактов составляет около 50–60%. Следует отметить связь анальной ВПЧ-инфекции, анального рака и предрака с ВИЧ. Заболеваемость среди ВИЧ-положительных пациентов выше, чем у ВИЧ-отрицательных. Методом ранней диагностики этих процессов является цитологический скрининг: анальная цитология оценивается по тем же критериям, что и цервикальная. Также высоко информативна аноскопия. Исследуют и лечат мужчин дерматовенерологи. При наличии вируса и отсутствии клиники – тактика наблюдательная, подразумевает ВПЧ-тест и цитологический скрининг раз в 6 месяцев. При наличии остроконечных кондилом их необходимо удалять.
Вакцинация: «за» и «против»
Особая тема – вакцинация девочек и молодых женщин для защиты от рака шейки матки. В США разработана и применяется с 2006 г. вакцина Гардасил, которая эффективна против четырех штаммов вируса. Вакцинацию проводят девочкам начиная с 11–12 лет. Четыре страны, в том числе США и Канада, ввели и вакцинацию мальчиков с целью снизить количество носителей вируса. У вакцинации есть много как сторонников, так и противников. Множество клинических исследований доказало, что если вакцину вводят девушкам, не имевшим сексуальных контактов и неинфицированным штаммами 16 и 18 (это может быть в том случае, если у нее не было в прошлом сексуальных отношений), то после полного курса вакцинации практически исключен риск инфицирования этими штаммами. Однако на сегодня риск поражений ШМ составляет 2% в вакцинированной популяции и 2,8% в невакцинированной. Последние данные свидетельствуют, что РШМ могут вызывать и штаммы, ранее считавшиеся неонкогенными.
При вакцинации молодых женщин, уже имевших сексуальные отношения, уровень снижения риска развития поражений шейки матки весьма невелик. Известный французский ученый Клод Беро (Claude Beraud) полагает, что вакцинация может усыпить бдительность подростков и приведет к тому, что они будут пренебрегать мерами защиты от инфекций и профилактическими исследованиями. А именно регулярные профилактические осмотры у гинекологов дают гарантию раннего обнаружения и излечения патологических процессов на шейке матки.
Спасение – в скрининге
Первой, в 1949 г., начала эту работу Канада. Скрининг дал немедленные результаты: сначала снижение заболеваемости на 78%, смертности – на 72%. В 50‑е годы США и Китай смогли снизить частоту РШМ более чем в 10 раз. В 60‑е годы скрининг начали проводить Япония, Финляндия, Швеция, Исландия, через десять лет к ним присоединились Германия, Бразилия и др. страны. Следствием этих действий стало снижение РШМ в этих странах в среднем на 50–80%.
В СССР приказ Минздрава о создании соответствующих лабораторий был издан в 1976 г. В настоящее время организованного скрининга РШМ в России нет. В 2002 году Департамент здравоохранения г. Москвы утвердил программу «Целевая диспансеризация женского населения по выявлению заболеваний шейки матки».
Цитологический скрининг проводился женщинам 35–69 лет один раз в три года. К 2010 г. общий процент случаев РШМ составил 22–24%, причем частота РШМ I–II стадии повысилась за годы исследования с 57 до 67%. Гинекологи настаивают на необходимости разработки национальной программы с определением кратности, объема и особенностей скрининга в различных возрастных группах женщин.
Научный центр акушерства, гинекологии и перинатологии им. академика В. И. Кулакова как главный методический центр страны планирует реализовать пилотный проект по скринингу рака шейки матки в Липецкой области. Цитологический метод – единственный для скрининга в больших популяциях.
Но его чувствительность неабсолютна: 66–83%. В 70–90% ложноотрицательные цитологические ответы случаются из-за низкого качества взятых мазков, в 10–30% налицо ошибочная интерпретация цитологических данных.
Именно уникальные возможности цитологического скрининга РШМ сохраняют здоровье и жизнь женщин. «С учетом его относительно низкой стоимости необходимо обеспечить именно организованный скрининг женщин. Следует рассмотреть вопрос о включении скрининга в систему обязательного медицинского страхования», – уверена профессор Аполихина.
Доказано, что финансовые затраты на проведение эффективного скрининга существенно ниже, чем на лечение больных с инвазивным раком шейки матки. Систему скрининга могут эффективно дополнить меры индивидуальной профилактики с использованием более частого обследования в группах повышенного риска с привлечением более дорогих, но гораздо более чувствительных молекулярно-биологических методов определения ДНК ВПЧ.
Только зарегистрированные и авторизованные пользователи могут оставлять комментарии.
0
много буков ниочем(
- ↓